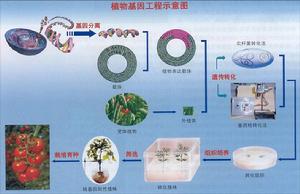
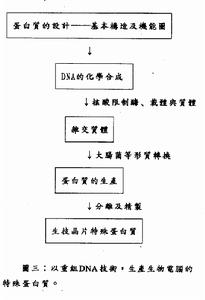
重组DNA技术
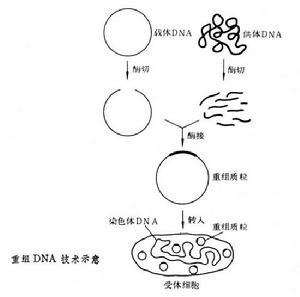
重组DNA技术(recombinantDNAtechnique)又称遗传工程,在体外重新组合脱氧核糖核酸(DNA)分子,并使它们在适当的细胞中增殖的遗传操作。这种操作可把特定的基因组合到载体上,并使之在受体细胞中增殖和表达。因此它不受亲缘关系限制,为遗传育种和分子遗传学研究开辟了崭新的途径。
自1977年成功地用大肠杆菌生产出生长Itl释放抑制因子以来,人胰岛素、人生长激素、胸腺肽、干扰素、尿激酶、肿瘤坏死因子、疯牛病疫苗、乙型肝炎病毒疫苗、甲型肝炎病毒疫苗、幼畜腹泻疫苗和青霉素酰化酶基因工程菌株等数十种基因工程产品相继问世。优质产毛羊等动物新品种,金色水稻,抗虫或抗除草剂的玉米、大豆、棉花、水稻,转类胡萝卜素生物合成相关酶基因花卉、蔬菜等已获推广或已取得阶段性成果。[1]
重组DNA技术来源于两个方面的基础理论研究——限制性核酸内切酶(简称限制酶)和基因载体(简称载体)。限制酶的研究可以追溯到1952年美国分子遗传学家S.E.卢里亚在大肠杆菌中所发现的一种所谓限制现象——从菌株甲的细菌所释放的噬菌体能有效地感染同一菌株的细菌,可是不能有效地感染菌株乙;少数被感染的菌株乙的细菌所释放的同一噬菌体能有效地感染菌株乙可是不能有效地感染菌株甲。经过长期的研究,美国学者W.阿尔伯在1974年终于对这一现象提出了解释,认为通过噬菌体感染而进入细菌细胞的DNA分子能被细菌识别而分解,细菌本身的DNA则由于已被自己所修饰(甲基化)而免于被分解。但有少数噬菌体在没有被分解以前已被修饰了,这些噬菌体经释放后便能有效地感染同一菌株的细菌。被甲(或乙)这一菌株所修饰的噬菌体只能有效地感染甲(或乙),而不能有效地感染乙(或甲),说明各个菌株对于外来DNA的限制作用常常是专一性的。通过进一步的研究发现这种限制现象是由于细菌细胞中具有专一性的限制性核酸内切酶的缘故。
重组DNA技术中所用的载体主要是质粒和温和噬菌体(见转导)两类,而在实际应用中的载体几乎都是经过改造的质粒或温和噬菌体。英国微生物遗传学家W.海斯和美国微生物遗传学家J.莱德伯格等在1952年首先认识到大肠杆菌的F因子(见细菌接合)是染色体外的遗传因子。1953年法国学者P.弗雷德里克等发现大肠杆菌产生大肠杆菌素这一性状为一种染色体外的大肠杆菌素因子所控制。1957年日本学者发现了抗药性质粒。后两类质粒都是在遗传工程中广泛应用的质粒。
重组DNA技术中广泛应用的噬菌体是大肠杆菌的温和噬菌体λ,它是在1951年由美国学者E.莱德伯格等发现的。到70年代初,生物化学研究的进展也为重组DNA技术奠定了基??972年美国的分子生物学家P.伯格等将动物病毒SV40的DNA与噬菌体P22的DNA连接在一起,构成了第一批重组体DNA分子。1973年美国的分子生物学家S.N.科恩等又将几种不同的外源DNA插入质粒pSC101的DNA中,并进一步将它们引入大肠杆菌中,从而开创了遗传工程的研究。
重组DNA片段的取得主要的方法有:①利用限制酶取得具有粘性末端或平整末端的DNA片段;②用机械方法剪切取得具有平整末端的DNA片段,例如用超声波断裂双链DNA分子;③经反向转录酶的作用从mRNA获得与mRNA顺序互补的DNA单链,然后再复制形成双链DNA(cDNA)。例如人的胰岛素和血红蛋白的结构基因都用这方法获得。这样获得的基因具有编码蛋白质的全部核苷酸顺序,但往往与原来位置在染色体上的基因在结构上有区别,它们不含有称为内含子的不编码蛋白质的间隔顺序(见基因);④用化学方法合成DNA片段。从蛋白质肽链的氨基酸顺序可以知道它的遗传密码。依照这密码用化学方法可以人工合成基因。
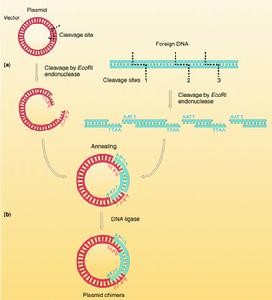
DNA片段和载体的连接DNA片段和载体相连接的方法主要有四种:①粘性末端连接,每一种限制性核酸内切酶作用于DNA分子上的特定的识别顺序,许多酶作用的结果产生具有粘性末端的两个DNA片段。例如来自大肠杆菌(Escherichiacoli)的限制酶EcoRI作用于识别顺序↓…GAATTC……CTTAAG…↑(↑指示切点),产生具有粘性末端…G…CTTAA和AATTC…G…的片段。把所要克隆的DNA和…载体DNA用同一种限制酶处理后再经DNA连接酶处理,就可以把它们连接起来。②平整末端连接,某些限制性内切酶作用的结果产生不含粘性末端的平整末端。例如来自副流感嗜血杆菌(Hemophilusparainfluenzae)的限制酶Hpal作用于识别顺序↓…GTTAAC……CAATTG…而产生末端为…GTT…GAA的DNA片段。用机械剪切方法取得的DNA片段的末端也是平整的。在某些连接酶(例如感染噬菌体T4后的大肠杆菌所产生的DNA连接酶)的作用下同样可以把两个这样的DNA片段连接起来。③同聚末端连接,在脱氧核苷酸转移酶(也称末端转移酶)的作用下可以在DNA的3′羧基端合成低聚多核苷酸。如果把所需要的DNA片段接上低聚腺嘌呤核苷酸,而把载体分子接上低聚胸腺嘧啶核苷酸,那么由于两者之间能形成互补氢键,同样可以通过DNA连接酶的作用而完成DNA片段和载体间的连接。④人工接头分子连接,在两个平整末端DNA片段的一端接上用人工合成的寡聚核苷酸接头片段,这里面包含有某一限制酶的识别位点。经这一限制酶处理便可以得到具有粘性末端的两个DNA片段,进一步便可以用DNA连接酶把这样两个DNA分子连接起来。
导入宿主细胞将连接有所需要的DNA的载体导入宿主细胞的常用方法有四种:①转化,用质粒作载体所常用的方法。②转染(见转化),用噬菌体DNA作载体所用的方法,这里所用的噬菌体DNA并没有包上它的外壳。③转导,用噬菌体作载体所用的方法,这里所用的噬菌体DNA被包上了它的外壳,不过这外壳并不是在噬菌体感染过程中包上,而是在离体情况下包上的,所以称为离体包装。④注射,如果宿主是比较大的动植物细胞则可以用注射方法把重组DNA分子导入。
选择用以上任何一种方法连接起来的DNA中既可能包括所需要的DNA片段,也可能包括并不需要的片段,甚至包括互相连接起来的载体分子的聚合体。所以接受这些DNA的宿主细胞中间只有一小部分是真正含有所需要的基因的。一般通过3种方法可以取得所需要的宿主细胞:①遗传学方法,对于带有抗药性基因的质粒来讲,从被转化细菌是否由敏感状态变为抗药的状态就可以知道它有没有获得这一抗药性质粒。一个抗药性基因中间如果接上了一段外来的DNA片段,就使获得这一质粒的细菌不再表现抗性。把一个带有两个抗性基因氨苄青霉素抗性和四环素抗性的质粒pBR322用限制酶BamHI处理,由于BamHI的唯一的识别位点是在四环素抗性基因中,所以经同一种酶处理的DNA分子片段就可以连接在这一基因中间。在被转化的细菌中选择只对氨苄青霉素具有抗性而对四环素不具抗性的细菌,便可以获得带有外来DNA片段的载体的细菌。这是一种常用的遗传学方法。②免疫学方法和分子杂交方法,当一个宿主细胞获得了携带在载体上的基因后,细胞中往往就出现这一基因所编码的蛋白质,用免疫学方法可以检出这种细胞。分子杂交的原理和方法同样可以用来检测这一基因的存在(见分子杂交、基因文库)。
基因表达在构建重组体DNA分子和选择宿主细胞时,还须考虑外源基因表达的问题。就是说要求外来的基因在宿主细胞中能准确地转录和翻译,所产生的蛋白质在宿主细胞中不被分解,而且最好还能分泌到细胞外。为了使外源基因表达,需要在基因编码顺序的5′端有能被宿主细胞识别的启动基因顺序以及核糖体的结合顺序。两种常用的方法能用来使外源基因在宿主细胞中顺利地表达:①在形成重组体DNA分子时在载体的启动基因顺序和核糖体结合顺序后面的适当位置上连接外源基因。例如将兔的β-珠蛋白基因或人的成纤维细胞干扰素基因分别连接到已经处在载体上的大肠杆菌乳糖操纵子的启动基因后面,便能使它们在大肠杆菌中顺利地表达;②将外源基因插入到载体的结构基因中的适当位置上,转录和翻译的结果将产生一个融合蛋白。这种融合蛋白质被提纯后,还要准确地将两部分分开,才能获得所需要的蛋白质。在早期的遗传工程研究中,生长激素释放抑制因子和鼠胰岛素基因的表达都是通过将它们连接在β-半乳糖苷酶基因中的方式实现的。
利用遗传工程手段还可以提高微生物本身所产生的酶的产量。例如可以把大肠杆菌连接酶的产量提高500倍。
理论研究应用重组DNA技术可以克隆和扩增某些原核生物和真核生物的基因,从而可以进一步研究它们的结构和功能。重组DNA技术的成就和提出的问题促进了遗传学、生物化学、微生物学、生物物理学和细胞学等学科的发展,并且有助于这些不同学科的结合。目前正在形成一门新兴的学科——生物工艺学或生物工程学,就是这种趋势的反映。
动植物育种和基因治疗已经有一些研究工作明确地预示着重组DNA技术在这些方面的潜力。例如把来自兔的β-血红蛋白基因注射到小鼠受精卵的核内,再将这种受精卵放回到小鼠输卵管内使它发育,在生下来的小鼠的肝细胞中发现有兔的β-血红蛋白基因和兔的β-血红蛋白。还有人把包括小鼠的金属巯基组氨酸三甲基内盐I(metallothioneineI)基因的启动子及大鼠生长激素结构基因的DNA片段注射进小鼠受精卵的前核中,由此发育得来的一部分小鼠由于带有可表达的大鼠生长激素基因,所以明显地比对照鼠长得大。这些实验结果为基因治疗展现了可喜的前景。固氮的功能涉及17个基因,分属7个操纵子,现在已能把它们全部引入酵母菌,而且能正常地复制,不过还没有能使这些基因表达。改造玉米胚乳蛋白质而使人畜营养必需的赖氨酸和色氨酸成分增加的工作也在着手进行。大豆的基因已能通过Ti质粒引入向日葵。因此,可以预期随着时间的推移在能源、农业、食品生产、工业化学和药品制造等方面都将会取得巨大的成果。
重组DNA技术或遗传工程最初是用来将DNA片段克隆到微生物宿主中,以过表达特定的基因产物用于进一步研究。重组DNA分子也已经用于获得遗传修饰生物体,如转基因和“基因敲除”动物以及转基因植物。
重组DNA技术已经对生物学和医学产生巨大影响,并且由于整个人类基因组的核酸序列已经被了解,极可能会产生更大的影响。成千上万种未知功能的基因将采用重组DNA技术来进行研究。基因治疗可能成为某些疾病的常规疗法,采用遗传工程技术将可以设计出许多新的基因转移载体。
同样地,采用重组DNA技术获得的转基因植物将可能在现代农业中扮演日益重要的角色。涉及到构建或使用GMOs的实验应首先进行生物安全评估。与该生物体有关的病原特性和所有潜在危害可能都是新型的,没有确定的。供体生物的特性、将要转移的DNA序列的性质、受体生物的特性以及环境特性等都需要进行评估。这些因素将有助于决定安全操作目标遗传修饰生物体所要求的生物安全水平,并确定应使用的生物学和物理防护系统。
·生物表达系统的生物安全考虑
生物表达系统由载体和宿主细胞组成。必须满足许多标准使其能有效、安全地使用。质粒pUC18是这样一种生物表达系统的实例。质粒pUC18经常与大肠杆菌K12细胞一起使用作为克隆载体,其完整测序已经完成。所有需要在其他细菌表达的基因已经从它的前体质粒pBR322中删除。大肠杆菌K12是一种非致病性菌株,它不能在健康人和动物的消化道中持久克隆。如果所要插入的外源DNA表达产物不要求更高级别的生物安全水平,那么大肠杆菌K12/pUC18可以在一级生物安全水平下按常规的遗传工程实验进行。
·表达载体的生物安全考虑
下列情况需要较高的生物安全水平:
1、来源于病原生物体的DNA序列的表达可能增加GMO的毒性
2、插入的DNA序列性质不确定,例如在制备病原微生物基因组DNA库的过程中
3、基因产物具有潜在的药理学活性
4、毒素的基因产物编码。
·用于基因转移的病毒载体
病毒载体(腺病毒载体)可以用于将基因有效地转移到其他细胞。这样的载体缺少病毒复制的某些基因,可以在能够补充这些缺陷的细胞株内繁殖。这类病毒载体的贮存液中可能污染了可复制病毒,它们是由繁殖细胞株中极少发生的自发性重组产生的。这些载体操作时应采用与用于获得这些载体的母体腺病毒相同的生物安全水平。
·转基因动物和“基因敲除”动物
携带外源性遗传信息的动物(转基因动物)应当在适合外源性基因产物特性的防护水平下进行操作。特定基因被有目的地删除的动物(“基因敲除”动物)一般不表现特殊的生物危害。包括那些表达病毒受体的转基因动物一般不会感染该种系病毒。如果这种动物从实验室逃离并将转移基因传给野生动物群体,那么理论上可以产生储存这些病毒的动物宿主。
目前已经就脊髓灰质炎病毒,特别是与根除脊髓灰质炎相关的问题讨论了上述可能性。由不同实验室获得的表达人脊髓灰质炎病毒受体的转基因小鼠,它们对不同接种途径的脊髓灰质炎病毒的感染都很敏感,所产生的疾病在临床和组织病理学上也与人脊髓灰质炎相类似。但小鼠模型与人不同的是,在口腔接种脊髓灰质炎病毒后,肠道内的病毒复制不充分或没有发生。因此,如果这种转基因小鼠逃到野外,几乎不可能产生脊髓灰质炎病毒新的宿主动物。但是,这个例子表明,对于每一种新的转基因动物,应当通过详细研究来确定动物的感染途径、感染所需的病毒接种量以及感染动物传播病毒的范围。此外,应当采取一切措施以确保对受体转基因小鼠的严密防护。
·转基因植物
那些表达了能够耐受除草剂或抵抗昆虫能力等基因的转基因植物,目前在世界许多地区都引起相当的争议。这些争议的焦点是这类植物作为食物的安全性,以及种植后的长期生态后果。表达动物或人源性基因的转基因植物用于研发医学产品和营养物品。通过危险度评估可以确定这些转基因植物产品所需的生物安全水平。
2、http://kepu.ccut.edu.cn/100k/read-htm-tid-3916.html
3、http://www.bbioo.com/bio101/2006/7015.htm
概述
基因工程是在分子水平上对基因进行操作的复杂技术,一般包括4个步骤:一是克隆目的基因,取得所需要的·DNA特异片段;二是将目的基因与DNA载体连接成重组DNA;三是将重组DNA引入细菌或动植物细胞内使其增殖;四是将表达目的基因的受体细胞挑选出来,使目的基因表达相应的蛋白质或其他产物,从而育成动植物优良新品种(系)。 自1977年成功地用大肠杆菌生产出生长Itl释放抑制因子以来,人胰岛素、人生长激素、胸腺肽、干扰素、尿激酶、肿瘤坏死因子、疯牛病疫苗、乙型肝炎病毒疫苗、甲型肝炎病毒疫苗、幼畜腹泻疫苗和青霉素酰化酶基因工程菌株等数十种基因工程产品相继问世。优质产毛羊等动物新品种,金色水稻,抗虫或抗除草剂的玉米、大豆、棉花、水稻,转类胡萝卜素生物合成相关酶基因花卉、蔬菜等已获推广或已取得阶段性成果。[1]
基本简介
广义的遗传工程包括细胞水平上的遗传操作(细胞工程)和分子水平上的遗传操作,即重组DNA技术(有人称之为基因工程)。狭义的遗传工程则专指后者。重组DNA技术来源于两个方面的基础理论研究——限制性核酸内切酶(简称限制酶)和基因载体(简称载体)。限制酶的研究可以追溯到1952年美国分子遗传学家S.E.卢里亚在大肠杆菌中所发现的一种所谓限制现象——从菌株甲的细菌所释放的噬菌体能有效地感染同一菌株的细菌,可是不能有效地感染菌株乙;少数被感染的菌株乙的细菌所释放的同一噬菌体能有效地感染菌株乙可是不能有效地感染菌株甲。经过长期的研究,美国学者W.阿尔伯在1974年终于对这一现象提出了解释,认为通过噬菌体感染而进入细菌细胞的DNA分子能被细菌识别而分解,细菌本身的DNA则由于已被自己所修饰(甲基化)而免于被分解。但有少数噬菌体在没有被分解以前已被修饰了,这些噬菌体经释放后便能有效地感染同一菌株的细菌。被甲(或乙)这一菌株所修饰的噬菌体只能有效地感染甲(或乙),而不能有效地感染乙(或甲),说明各个菌株对于外来DNA的限制作用常常是专一性的。通过进一步的研究发现这种限制现象是由于细菌细胞中具有专一性的限制性核酸内切酶的缘故。
重组DNA技术中所用的载体主要是质粒和温和噬菌体(见转导)两类,而在实际应用中的载体几乎都是经过改造的质粒或温和噬菌体。英国微生物遗传学家W.海斯和美国微生物遗传学家J.莱德伯格等在1952年首先认识到大肠杆菌的F因子(见细菌接合)是染色体外的遗传因子。1953年法国学者P.弗雷德里克等发现大肠杆菌产生大肠杆菌素这一性状为一种染色体外的大肠杆菌素因子所控制。1957年日本学者发现了抗药性质粒。后两类质粒都是在遗传工程中广泛应用的质粒。
重组DNA技术中广泛应用的噬菌体是大肠杆菌的温和噬菌体λ,它是在1951年由美国学者E.莱德伯格等发现的。到70年代初,生物化学研究的进展也为重组DNA技术奠定了基??972年美国的分子生物学家P.伯格等将动物病毒SV40的DNA与噬菌体P22的DNA连接在一起,构成了第一批重组体DNA分子。1973年美国的分子生物学家S.N.科恩等又将几种不同的外源DNA插入质粒pSC101的DNA中,并进一步将它们引入大肠杆菌中,从而开创了遗传工程的研究。
相关概念
·克隆与克隆化
·DNA克隆
DNA克隆就是应用酶学的方法,在体外将各种来源的遗传物质与载体DNA结合成一具有自我复制能力的DNA分子——复制子,继而通过转化或转染宿主细胞、筛选出含有目的基因转化子细胞,再进行扩增、提取获得大量同一DNA分子,即DNA克隆又称重组DNA。
·工具酶
在重组DNA技术中,常需要一些基本工具酶进行基因操作。小结:重组DNA技术常用工具酶(1)限制性内切酶:识别特异序列,切割DNA。(2)DNA连接酶:催化DNA中相邻的5′磷酸基与3′羟基间形成磷酸二酯键,使DNA切口封合,连接DNA片段。(3)DNA聚合酶Ⅰ:a.合成双链cDNA中第二条链。?b.缺口平移制做探针。?c.DNA序列分析。?d.填补3′末端。(4)Taq酶催化PCR反应,聚合DNA。(5)反转录酶a.合成cDNA。b.替代DNA聚合酶Ⅰ进行填补,标记或DNA序列分析,(6)多聚核苷酸激酶催化DNA5′羟基末端磷酸化,或标记探针。(7)碱性磷酸酶切除DNA5′末端磷酸基。(8)末端转移酶在3′羟基末端进行同系多聚核苷酸加尾。(9)DNA酶:切割DNA(10)RNA酶:切割RNA。
在所在工具酶中,限制性核酶内切酶具有特别重要的意义。所谓限制性核酸内切酶就是识别DNA的特异序列,并在识别点或其周围切割双链DNA的一类内切酶。根据酶的组成,所需因子及裂解DNA方式的不同,可将限制性核酸内切酶分为三类。重组DNA技术中常用的限制性核酸内切酶为Ⅱ类酶,大部分Ⅱ类酶识别DNA位点的核苷酸序列呈二元旋转对称,通常称这种特殊的结构顺序为回文结构。
步骤和技术路线
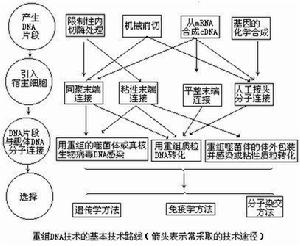
重组DNA技术一般包括四步:①产生DNA片段;②DNA片段与载体DNA分子相连接;③将重组DNA分子导入宿主细胞;④选出含有所需要的重组体DNA分子的宿主细胞。在具体工作中选择哪条技术路线。主要取决于基因的来源、基因本身的性质和该项遗传工程的目的。重组DNA片段的取得主要的方法有:①利用限制酶取得具有粘性末端或平整末端的DNA片段;②用机械方法剪切取得具有平整末端的DNA片段,例如用超声波断裂双链DNA分子;③经反向转录酶的作用从mRNA获得与mRNA顺序互补的DNA单链,然后再复制形成双链DNA(cDNA)。例如人的胰岛素和血红蛋白的结构基因都用这方法获得。这样获得的基因具有编码蛋白质的全部核苷酸顺序,但往往与原来位置在染色体上的基因在结构上有区别,它们不含有称为内含子的不编码蛋白质的间隔顺序(见基因);④用化学方法合成DNA片段。从蛋白质肽链的氨基酸顺序可以知道它的遗传密码。依照这密码用化学方法可以人工合成基因。
DNA片段和载体的连接DNA片段和载体相连接的方法主要有四种:①粘性末端连接,每一种限制性核酸内切酶作用于DNA分子上的特定的识别顺序,许多酶作用的结果产生具有粘性末端的两个DNA片段。例如来自大肠杆菌(Escherichiacoli)的限制酶EcoRI作用于识别顺序↓…GAATTC……CTTAAG…↑(↑指示切点),产生具有粘性末端…G…CTTAA和AATTC…G…的片段。把所要克隆的DNA和…载体DNA用同一种限制酶处理后再经DNA连接酶处理,就可以把它们连接起来。②平整末端连接,某些限制性内切酶作用的结果产生不含粘性末端的平整末端。例如来自副流感嗜血杆菌(Hemophilusparainfluenzae)的限制酶Hpal作用于识别顺序↓…GTTAAC……CAATTG…而产生末端为…GTT…GAA的DNA片段。用机械剪切方法取得的DNA片段的末端也是平整的。在某些连接酶(例如感染噬菌体T4后的大肠杆菌所产生的DNA连接酶)的作用下同样可以把两个这样的DNA片段连接起来。③同聚末端连接,在脱氧核苷酸转移酶(也称末端转移酶)的作用下可以在DNA的3′羧基端合成低聚多核苷酸。如果把所需要的DNA片段接上低聚腺嘌呤核苷酸,而把载体分子接上低聚胸腺嘧啶核苷酸,那么由于两者之间能形成互补氢键,同样可以通过DNA连接酶的作用而完成DNA片段和载体间的连接。④人工接头分子连接,在两个平整末端DNA片段的一端接上用人工合成的寡聚核苷酸接头片段,这里面包含有某一限制酶的识别位点。经这一限制酶处理便可以得到具有粘性末端的两个DNA片段,进一步便可以用DNA连接酶把这样两个DNA分子连接起来。
导入宿主细胞将连接有所需要的DNA的载体导入宿主细胞的常用方法有四种:①转化,用质粒作载体所常用的方法。②转染(见转化),用噬菌体DNA作载体所用的方法,这里所用的噬菌体DNA并没有包上它的外壳。③转导,用噬菌体作载体所用的方法,这里所用的噬菌体DNA被包上了它的外壳,不过这外壳并不是在噬菌体感染过程中包上,而是在离体情况下包上的,所以称为离体包装。④注射,如果宿主是比较大的动植物细胞则可以用注射方法把重组DNA分子导入。
选择用以上任何一种方法连接起来的DNA中既可能包括所需要的DNA片段,也可能包括并不需要的片段,甚至包括互相连接起来的载体分子的聚合体。所以接受这些DNA的宿主细胞中间只有一小部分是真正含有所需要的基因的。一般通过3种方法可以取得所需要的宿主细胞:①遗传学方法,对于带有抗药性基因的质粒来讲,从被转化细菌是否由敏感状态变为抗药的状态就可以知道它有没有获得这一抗药性质粒。一个抗药性基因中间如果接上了一段外来的DNA片段,就使获得这一质粒的细菌不再表现抗性。把一个带有两个抗性基因氨苄青霉素抗性和四环素抗性的质粒pBR322用限制酶BamHI处理,由于BamHI的唯一的识别位点是在四环素抗性基因中,所以经同一种酶处理的DNA分子片段就可以连接在这一基因中间。在被转化的细菌中选择只对氨苄青霉素具有抗性而对四环素不具抗性的细菌,便可以获得带有外来DNA片段的载体的细菌。这是一种常用的遗传学方法。②免疫学方法和分子杂交方法,当一个宿主细胞获得了携带在载体上的基因后,细胞中往往就出现这一基因所编码的蛋白质,用免疫学方法可以检出这种细胞。分子杂交的原理和方法同样可以用来检测这一基因的存在(见分子杂交、基因文库)。
基因表达在构建重组体DNA分子和选择宿主细胞时,还须考虑外源基因表达的问题。就是说要求外来的基因在宿主细胞中能准确地转录和翻译,所产生的蛋白质在宿主细胞中不被分解,而且最好还能分泌到细胞外。为了使外源基因表达,需要在基因编码顺序的5′端有能被宿主细胞识别的启动基因顺序以及核糖体的结合顺序。两种常用的方法能用来使外源基因在宿主细胞中顺利地表达:①在形成重组体DNA分子时在载体的启动基因顺序和核糖体结合顺序后面的适当位置上连接外源基因。例如将兔的β-珠蛋白基因或人的成纤维细胞干扰素基因分别连接到已经处在载体上的大肠杆菌乳糖操纵子的启动基因后面,便能使它们在大肠杆菌中顺利地表达;②将外源基因插入到载体的结构基因中的适当位置上,转录和翻译的结果将产生一个融合蛋白。这种融合蛋白质被提纯后,还要准确地将两部分分开,才能获得所需要的蛋白质。在早期的遗传工程研究中,生长激素释放抑制因子和鼠胰岛素基因的表达都是通过将它们连接在β-半乳糖苷酶基因中的方式实现的。
应用介绍
发酵工业用大肠杆菌生产人的生长激素释放抑制因子是第一个成功的实例。在9升细菌培养液中这种激素的产量等于从大约50万头羊的脑中提取得到的量。这是把人工合成的基因连接到小型多拷贝质粒pBR322上,并利用乳糖操纵子β-半乳糖苷酶基因的高效率启动子,构成新的杂种质粒而实现的。现在胰岛素、人的生长激素、人的胸腺激素α-1、人的干扰素、牛的生长激素、乙型肝炎病毒抗原和口蹄疫病毒抗原等都可用大肠杆菌发酵生产,其中有的还可在酵母或枯草杆菌中表达,这就为大规模的工业发酵开辟了新的途径。还有些很重要的基因,如纤维素酶的基因等也已在大肠杆菌中克隆和表达。利用遗传工程手段还可以提高微生物本身所产生的酶的产量。例如可以把大肠杆菌连接酶的产量提高500倍。
理论研究应用重组DNA技术可以克隆和扩增某些原核生物和真核生物的基因,从而可以进一步研究它们的结构和功能。重组DNA技术的成就和提出的问题促进了遗传学、生物化学、微生物学、生物物理学和细胞学等学科的发展,并且有助于这些不同学科的结合。目前正在形成一门新兴的学科——生物工艺学或生物工程学,就是这种趋势的反映。
动植物育种和基因治疗已经有一些研究工作明确地预示着重组DNA技术在这些方面的潜力。例如把来自兔的β-血红蛋白基因注射到小鼠受精卵的核内,再将这种受精卵放回到小鼠输卵管内使它发育,在生下来的小鼠的肝细胞中发现有兔的β-血红蛋白基因和兔的β-血红蛋白。还有人把包括小鼠的金属巯基组氨酸三甲基内盐I(metallothioneineI)基因的启动子及大鼠生长激素结构基因的DNA片段注射进小鼠受精卵的前核中,由此发育得来的一部分小鼠由于带有可表达的大鼠生长激素基因,所以明显地比对照鼠长得大。这些实验结果为基因治疗展现了可喜的前景。固氮的功能涉及17个基因,分属7个操纵子,现在已能把它们全部引入酵母菌,而且能正常地复制,不过还没有能使这些基因表达。改造玉米胚乳蛋白质而使人畜营养必需的赖氨酸和色氨酸成分增加的工作也在着手进行。大豆的基因已能通过Ti质粒引入向日葵。因此,可以预期随着时间的推移在能源、农业、食品生产、工业化学和药品制造等方面都将会取得巨大的成果。
内容评价
重组DNA技术涉及到组合不同来源的遗传信息,从而创造自然界以前可能从未存在过的遗传修饰生物体(geneticallymodifiedorganisms,GMOs)。最初,在分子生物学家中有人担心这些生物体可能具有不可预测的不良性状,一旦从实验室逸出将带来生物学危害。这种担心在1975年美国加利福尼亚州阿西洛马市召开的科学会议[45]上成为焦点。在那次会议上讨论了重组DNA技术的安全问题并提出了第一个重组DNA技术指南。接下来25年多的研究经验证实,在进行了适当的危险度评估并采用了适当的安全措施以后,可以安全地进行遗传工程工作。重组DNA技术或遗传工程最初是用来将DNA片段克隆到微生物宿主中,以过表达特定的基因产物用于进一步研究。重组DNA分子也已经用于获得遗传修饰生物体,如转基因和“基因敲除”动物以及转基因植物。
重组DNA技术已经对生物学和医学产生巨大影响,并且由于整个人类基因组的核酸序列已经被了解,极可能会产生更大的影响。成千上万种未知功能的基因将采用重组DNA技术来进行研究。基因治疗可能成为某些疾病的常规疗法,采用遗传工程技术将可以设计出许多新的基因转移载体。
同样地,采用重组DNA技术获得的转基因植物将可能在现代农业中扮演日益重要的角色。涉及到构建或使用GMOs的实验应首先进行生物安全评估。与该生物体有关的病原特性和所有潜在危害可能都是新型的,没有确定的。供体生物的特性、将要转移的DNA序列的性质、受体生物的特性以及环境特性等都需要进行评估。这些因素将有助于决定安全操作目标遗传修饰生物体所要求的生物安全水平,并确定应使用的生物学和物理防护系统。
·生物表达系统的生物安全考虑
生物表达系统由载体和宿主细胞组成。必须满足许多标准使其能有效、安全地使用。质粒pUC18是这样一种生物表达系统的实例。质粒pUC18经常与大肠杆菌K12细胞一起使用作为克隆载体,其完整测序已经完成。所有需要在其他细菌表达的基因已经从它的前体质粒pBR322中删除。大肠杆菌K12是一种非致病性菌株,它不能在健康人和动物的消化道中持久克隆。如果所要插入的外源DNA表达产物不要求更高级别的生物安全水平,那么大肠杆菌K12/pUC18可以在一级生物安全水平下按常规的遗传工程实验进行。
·表达载体的生物安全考虑
下列情况需要较高的生物安全水平:
1、来源于病原生物体的DNA序列的表达可能增加GMO的毒性
2、插入的DNA序列性质不确定,例如在制备病原微生物基因组DNA库的过程中
3、基因产物具有潜在的药理学活性
4、毒素的基因产物编码。
·用于基因转移的病毒载体
病毒载体(腺病毒载体)可以用于将基因有效地转移到其他细胞。这样的载体缺少病毒复制的某些基因,可以在能够补充这些缺陷的细胞株内繁殖。这类病毒载体的贮存液中可能污染了可复制病毒,它们是由繁殖细胞株中极少发生的自发性重组产生的。这些载体操作时应采用与用于获得这些载体的母体腺病毒相同的生物安全水平。
·转基因动物和“基因敲除”动物
携带外源性遗传信息的动物(转基因动物)应当在适合外源性基因产物特性的防护水平下进行操作。特定基因被有目的地删除的动物(“基因敲除”动物)一般不表现特殊的生物危害。包括那些表达病毒受体的转基因动物一般不会感染该种系病毒。如果这种动物从实验室逃离并将转移基因传给野生动物群体,那么理论上可以产生储存这些病毒的动物宿主。
目前已经就脊髓灰质炎病毒,特别是与根除脊髓灰质炎相关的问题讨论了上述可能性。由不同实验室获得的表达人脊髓灰质炎病毒受体的转基因小鼠,它们对不同接种途径的脊髓灰质炎病毒的感染都很敏感,所产生的疾病在临床和组织病理学上也与人脊髓灰质炎相类似。但小鼠模型与人不同的是,在口腔接种脊髓灰质炎病毒后,肠道内的病毒复制不充分或没有发生。因此,如果这种转基因小鼠逃到野外,几乎不可能产生脊髓灰质炎病毒新的宿主动物。但是,这个例子表明,对于每一种新的转基因动物,应当通过详细研究来确定动物的感染途径、感染所需的病毒接种量以及感染动物传播病毒的范围。此外,应当采取一切措施以确保对受体转基因小鼠的严密防护。
·转基因植物
那些表达了能够耐受除草剂或抵抗昆虫能力等基因的转基因植物,目前在世界许多地区都引起相当的争议。这些争议的焦点是这类植物作为食物的安全性,以及种植后的长期生态后果。表达动物或人源性基因的转基因植物用于研发医学产品和营养物品。通过危险度评估可以确定这些转基因植物产品所需的生物安全水平。
相关词条
| 糖蛋白 | 卵子 | 沥青 | 视网膜 | 蔗糖素 |
| 磷酸 | 染色质 | 氢氧化钠 | 酚酞 | 糖精 |
| 癌细胞 | 染色体 | 煤油 | 酱油 | 冰糖 |
| 细胞分裂 | 蓝宝石 | 石蜡 | 免疫细胞 | 二氧化硅 |
| 精子 | 氟里昂 | 干燥剂 | 红糖 | 高锰酸钾 |
相关链接
1、http://www.eol.cn/article/20041020/3118398.shtml2、http://kepu.ccut.edu.cn/100k/read-htm-tid-3916.html
3、http://www.bbioo.com/bio101/2006/7015.htm
附件列表
词条内容仅供参考,如果您需要解决具体问题
(尤其在法律、医学等领域),建议您咨询相关领域专业人士。
如果您认为本词条还有待完善,请 编辑