吗啉基
吗啉基(Morpholino)编辑本段
吗啉代寡核苷酸(Morpholino Oligonucleotides) 是一类人工合成的核酸类似物,通过特异性结合靶标RNA(如mRNA或pre-mRNA)调控基因表达,广泛应用于基因功能研究、疾病模型构建及潜在治疗开发。是一种用来修饰基因表现的分子,吗啉基寡核苷酸是一种反义技术,可用来阻碍其他分子与特定核酸序列的结合。可阻挡RNA上约25个碱基的区域。此分子可应用在一些模式生物的研究上,包括小鼠(mice)、斑马鱼(zebrafish)、Xenopus(一类青蛙)等。
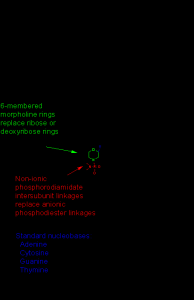
除了组合成寡核苷酸之外,吗啉基也可能出现在其他分子中。但“Morpholino”指其寡核苷酸形式,也就是磷酰二胺吗啉代寡核苷酸(phosphorodiamidate morpholino oligomers,PMO)。吗啉基是对天然核苷酸结构重新设计获得的合成分子。长度多为25个碱基,以标准核苷酸碱基配对的方式与RNA互补结合。在结构上来看,吗啉基与DNA的区别在于尽管前者有标准的核苷酸碱基,这些碱基却连接在吗啉环上,而非脱氧核糖环。吗啉通过占据体内mRNA与其它分子作用位点来发生作用。
合成MORPHOLINO的公司编辑本段
GENE TOOLS公司成立于1997年,位于AVI Biopharma公司旗下,是一家生产生物学和医学研究所需的序列个性化的Morpholino oligos的生物技术公司。其Morpholino产品从2000年开始商业化,目前已经有1700篇研究型论文涉及到Morpholino。
GENE TOOLS的初级产品Morpholino反义核苷酸,是合成分子,阻断特定基因活性的Morpholino。Morpholino的亚单位的连接顺序决定了受其阻断的目的基因。GENE TOOLS公司根据客户需要,设计关闭目的基因活性的个性化Morpholino。GENE TOOLS公司通常每周能够合成200多个Morpholino。
GENE TOOLS的客户一般是大学、研究所和制药公司的研究人员。
发育生物学家通过将 Morpholino oligos注入卵子或者斑马鱼、青蛙、海鞘、海胆等的受精卵中研究胚胎发育
细胞生物学家利用Morpholino oligos研究新经过测序的基因的功能
医疗工作者利用Morpholino oligos研究癌症等疾病的细胞学机制
1. 吗啉代的结构与化学特性
基本组成:
吗啉环:替代天然核酸中的核糖/脱氧核糖,形成六元吗啉环结构(含一个氧和氮原子)。
磷酸二酰胺键:连接吗啉环,替代天然磷酸二酯键,增强抗核酸酶降解能力。
碱基配对:保留A、T、C、G碱基,通过Watson-Crick配对与靶RNA结合。
化学稳定性:
对核酸酶(如RNase、DNase)高度耐受,半衰期长达数天至数周。
无电荷,需依赖物理方法(显微注射、电穿孔)或载体(如Endo-Porter)递送入细胞。
2. 作用机制
(1) 基因表达抑制
翻译阻断:结合mRNA的5'UTR或起始密码子区域,阻止核糖体组装,抑制蛋白质合成。
剪接调控:靶向pre-mRNA的剪接位点(如外显子-内含子交界区),诱导外显子跳跃或保留,改变成熟mRNA结构。
(2) miRNA抑制
结合microRNA(miRNA)或miRNA结合位点,阻断miRNA与靶mRNA的相互作用(即“miRNA sponge”功能)。
3. 应用领域
(1) 基础研究
基因功能解析:在模式生物(斑马鱼、非洲爪蟾胚胎)中快速敲低基因,研究发育表型。
可变剪接研究:设计剪接调控型吗啉代,生成特定剪接异构体(如Duchenne肌营养不良模型中跳过突变外显子)。
(2) 疾病模型构建
急性基因沉默:模拟遗传病突变效应(如心血管疾病、神经退行性疾病)。
病毒复制抑制:靶向病毒RNA关键区域(如登革热病毒基因组保守区)。
(3) 治疗探索
反义疗法:临床试验中用于杜氏肌营养不良(如Eteplirsen,跳过DMD基因第51号外显子)。
抗感染:抑制病原体关键基因(如结核杆菌耐药基因)。
4. 实验设计与优化
(1) 靶标选择
序列特异性:设计20-25个碱基,避免自身互补或重复序列,使用软件(如Gene Tools)预测特异性。
结合位点:
翻译阻断:靶向mRNA起始密码子附近(如-25至+25区域)。
剪接调控:覆盖剪接供体/受体位点或外显子剪接增强子。
(2) 递送方法
显微注射:斑马鱼胚胎、蛙卵等模式生物的直接注射(浓度通常为0.1-1 mM)。
电穿孔:适用于体外培养细胞或组织(如小鼠视网膜)。
载体辅助:
Endo-Porter:通过内吞作用将吗啉代递送入胞质。
纳米颗粒:提高体内递送效率(如脂质体包裹)。
(3) 对照设计
标准阴性对照:随机序列吗啉代(无已知靶标)。
表型拯救实验:共注射靶标mRNA(无吗啉代结合位点)验证特异性。
5. 优缺点分析
| 优势 | 局限性 |
|---|---|
| 高特异性与稳定性(无RNase H激活) | 需物理递送,体内应用受限 |
| 快速起效(数小时内抑制蛋白表达) | 脱靶效应(高浓度时可能结合相似序列) |
| 适用于胚胎/活体研究(低毒性) | 瞬时效应(通常维持3-5天) |
| 可逆性(代谢后功能恢复) | 设计不当可能导致非预期剪接 |
6. 与其他基因沉默技术的对比
| 技术 | 作用机制 | 持续时间 | 递送难度 | 应用场景 |
|---|---|---|---|---|
| 吗啉代 | 阻断翻译/剪接(不降解RNA) | 数天至数周 | 高 | 胚胎、急性实验 |
| siRNA | RNAi介导mRNA降解 | 数天 | 中 | 细胞系、部分体内模型 |
| CRISPR/Cas9 | DNA水平敲除或编辑 | 永久 | 高 | 遗传修饰、长期效应研究 |
| shRNA | 稳定整合基因组,持续RNAi | 长期 | 中 | 转基因动物、细胞系 |
7. 注意事项与挑战
脱靶效应:通过生物信息学筛选及多吗啉代交叉验证减少假阳性。
剂量优化:过高浓度可能导致非特异性毒性(如细胞死亡或发育异常)。
体内递送:开发新型递送系统(如肽偶联吗啉代)以提升组织靶向性。
8. 研究前沿
共价吗啉代:通过光交联技术固定靶RNA-吗啉代复合物,用于结构解析。
多功能偶联:结合荧光标记(如FITC)实时追踪吗啉代分布。
临床转化:优化吗啉代化学修饰(如vivo-morpholino)延长体内半衰期。
总结
吗啉代寡核苷酸凭借其高稳定性、可逆性及精准的基因调控能力,成为发育生物学与疾病机制研究的利器。尽管递送挑战限制了其临床应用,但通过化学修饰与新型载体开发,其在反义治疗与个性化医疗中的潜力正逐步释放。实验成功的关键在于严谨的靶标设计、递送方法优化及多重对照验证。
附件列表
词条内容仅供参考,如果您需要解决具体问题
(尤其在法律、医学等领域),建议您咨询相关领域专业人士。